-
- Pourquoi
bâillons-nous ? Revue des théories
d'Hippocrate à nos jours Walusinski O
2014
-
- Résumé:
Le bâillement apparaît comme un
modèle d'étude pertinent
d'archéologie comportementale.
L'échographie en découvre la
précocité
ontogénétique entre 12 et 15
semaines de grossesse.
Phylogénétiquement ancien,
l'éthologie le décrit comme un
comport;ement stéréotypé
retrouvé des reptiles aux poissons, des
oiseaux aux mammifères. Son
universalité et sa survivance sans
variation évolutive postulent tant de sa
particulière importance que de sa
nécessité developpementale, alors
que la puissante contraction musculaire qui le
caractérise a un coût
métabolique élevé. Il
naît du noyau paraventriculaire de
l'hypothalamus qui projette vers le tronc
cérébral et la moelle cervicale,
sièges des centres moteurs
exécutifs. Cette origine hypothalamique
et la nature des neuromédiateurs
impliqués confirment son rôle dans
l'homéostasie des systèmes
stimulant l'éveil, grâce au
rétrocontrôle que sa puissante
contraction musculaire exerce sur la
réticulée ascendante du tronc
cérébral. Son ontogenèse
accompagne l'apparition du sommeil paradoxal,
première forme de sommeil. Sa
fréquence quotidienne suit une
évolution parallèle à la
proportion du temps passé en sommeil
paradoxal tout au long de la vie. Présent
de la naissance à la mort, sans
modification morphologique, le bâillement
a une valeur sémiologique comme
témoin de l'activité du cerveau
«reptilien» de l'Homme.
-
- Abstract
: The yawn is one of the most underappreciated
of behaviors. It is a stereotyped and often
repetitive motor act characterized by gaping of
the mouth accompanied by a long inspiration, a
brief acme followed by a short expiration. The
vigor of the act may increase arousal. Although
socially offensive to many, yawns often bring
pleasure to the yawner. While infuenced by
several neurotransmitters, yawning is strongly
affected by dopamine. Dopamine activates
oxytocin production in the paraventricular
nucleus of the hypothalamus, oxytocin may then
activate cholinergic neurotransmission in the
hippocampus and the reticular formation of the
brainstem. Acethylcholine induces yawning via
the muscarinic receptors of effectors. Other
neurotransmitters can modulate its occurence
like serotonine, neuropeptides, hypocretin and
sexual hormones. The decrease of yawning in the
elderly suggests an associated decrease of
dopaminergic activity. Yawning and stretching
have related phylogenetic old origins.
Ethologists agree that most vertebrates yawn.
Yawning is morphologically similar in reptiles,
birds, mammals and fishs. They may be ancestral
vestiges surviving throughout evolution with
little variation. In the human embryo, yawning
occurs as early as 12 weeks after conception and
remains relatively unchanged throughout life.
Across the life span, night sleep undergoes
several age-related modifications. Theses
changes concern sleep duration and the amount of
REM and NREM sleep. We can describe, for the
duration of REM sleep, a curvilinear trend with
a steep descending slope in the last time of
fetus life and the first year of life, a plateau
level across childhood and adulthood, slowly
lowering until age. A parallel curve
demonstrates the similarity of the evolution of
yawn's frequency and the amount of REM sleep.
Thus, from ontogeny, phylogeny and this modeling
approach emerges a pivotal link between yawning
and REM sleep.
-
- Antoine Roquentin: « Je bâille
si fort qu'une larme me vient aux yeux.
[...] Je m'ennuie, c'est tout. De temps
en temps je bâille si fort que les larmes
me roulent sur les joues. C'est un ennui
profond, profond, le cœur profond de
l'existence, la matière même dont
je suis fait ». Jean-Paul Sartre, La
nausée (1938).
 - Le bâillement est un comportement
involontaire au déroulement
stéréotypé. En 5 à
10 secondes vont se succéder une longue
et ample inspiration, une brève
apnée à thorax plein, une
expiration passive. Ce cycle respiratoire peut
être accompagné d'un
étirement du tronc et des membres, ce qui
se nomme une pandiculation. Son analyse montre
une intense contraction simultanée et
paradoxale, car faisant intervenir des muscles
antagonistes, les uns ouvrant la bouche
(digastriques), les autres la fermant
(masséters), et des muscles de la nuque,
portant la tête en arrière. J.
Barbizet (1958) a montré que le pharynx
quadruplait son diamètre, performance
unique au bâillement. La pandiculation est
une intense contraction des muscles
antigravitaires, réalisant un
étirement
généralisé. C'est la
contraction maximale du diaphragme qui est
responsable de l'ample inspiration, donnant
ainsi au bâillement un rôle
ventilatoire apparent. Il est donc
inféré que le bâillement
n'est qu'une part
céphalo-cervico-diaphragmatique de la
pandiculation (Fraser, 1989; Walusinski,
2004).
-
- Le bâillement, toujours involontaire,
une fois déclenché, peut
être modulé par la volonté,
soit en accentuant toutes les phases, soit en
minimisant l'ouverture de la bouche et les
bruits expiratoires, mais sans jamais pouvoir
être empêché (Baenninger,
1997). Moindre audition, paupières
fermées et sensation de plénitude
corporelle, concourent à une relative
perte de contact avec l'environnement. Le
bâillement est souvent perçu comme
une brève jouissance, un bref
bien-être, ressemblant à ce
qu'expriment les tiqueurs après
l'exécution de leur tic, un temps
volontairement inhibé (Greco, 1993).
-
- Présent chez les
vertébrés poïkilothermes et
homéothermes, des reptiles au cerveau
rudimentaire, dit archaïque, jusqu'aux
primates humains, dans le monde marin,
aérien et terrestre, le bâillement
est décrit dans la littérature
éthologique, neurophysiologique et
neuropsychologique associé aux
alternances des rythmes veille - sommeil,
à l'alimentation, à la
sexualité, où il apparaît
comme un comportement témoin des
mécanismes concourant à la
stimulation de l'éveil et du rôle
central de l'hypothalamus dans
l'homéostasie (Aubin, 1988; Daquin, 2001;
Walusinski, 2004).
-
- Reconnaissable à l'échographie
dès quatorze semaines de grossesse, il
témoigne, comme l'apparition de
mouvements oro-mandibulaires et de
déglutition, de la maturation
fonctionnelle du tronc cérébral et
des noyaux gris centraux alors que l'extension
du cortex fronto-pariéto-temporal se
poursuit jusqu'à 24 semaines (Abadie,
1999). Aucune structure cérébrale
n'a jamais pû être identifiée
comme centre du bâillement. Des arguments
cliniques et pharmacologiques indiquent que
l'hypothalamus et en particulier le noyau
paraventriculaire, les régions bulbaires
et pontiques, avec des connexions frontales chez
les primates (l'Homme, les chimpanzés,
les bonobos) et à la moelle cervicale
sont indispensables à sa
réalisation. Les muscles qui se
contractent pendant le bâillement
dépendent des nerfs crâniens V,
VII, IX, X, XI, XII, des nerfs cervicaux C1-C4
(nerf phrénique) et des nerfs dorsaux
innervant les intercostaux, muscles
respiratoires accessoires (Chouard,1990).
-
- Le paradigme ancien qui, d'Hippocrate au
milieu du XXe siècle, a fait de ce
comportement un réflexe
d'oxygénation cérébrale
doit être oublié au profit d'un
paradigme neuromusculaire à commande sous
corticale (Provine, 1987). Le noyau
paraventriculaire de l'hypothalamus contient les
corps cellulaires des neurones ocytocinergiques
projetant sur l'hippocampe, la
réticulée du tronc
cérébral, le locus cœruleus.
Quand ces neurones sont stimulés par la
dopamine, les acides aminés excitateurs,
ou l'ocytocine elle-même, ils
déclenchent le comportement de
bâiller en libérant de l'ocytocine
dans ces différentes structures
sous-corticales. Cette activation
ocytocinergique est inhibée par les
opioïdes qui empêchent le
bâillement. L'activation ou l'inhibition
de ces neurones ocytocinergiques sont
corrélées à
l'activité ou non de l'oxyde nitrique
synthétase paraventriculaire. D'autres
systèmes neuronaux sont impliqués
à titre de modulateurs. La
sérotonine, les œstrogènes,
la testostérone, l'hypocrétine
interviennent soit au niveau du noyau
paraventriculaire soit au niveau des noyaux
moteurs du tronc cérébral et de la
mœlle, voie finale exécutive
dépendante de l'acétylcholine
(Argiolas, 1998; Daquin, 2001; Sato-Suzuki,
2002).
-
- Le bâillement au cours de la
vie.
- L'étude de la fréquence des
bâillements, tant au cours du
nycthémère que suivant les
âges de la vie, sont peu nombreuses. Les
méthodologies de recueil des
données restent empiriques. Le plus
souvent, c'est l'auto comptage avec, soit par
écrits sur un carnet (Greco, 1989;
Walusinski, 2000), soit par impulsions digitales
sur un compteur portable, par des patients
ambulants, qui a été
utilisé (Baenninger, 1996). Chez les
enfants, le monitorage visuel par un personnel
de pouponnière, a été
réalisé par périodes de
quelques heures à différents
moments de la journée (Holditch-Davis,
2003). M. Greco et R. Baenninger (1991) ont
donné des activités de lecture ou
de visionnage d'images à leurs
étudiants, en les appareillant
d'électrodes de conductance
cutanée. La tache, dans laquelle ils
étaient engagés, était en
fait un leurre et des observateurs cachés
scrutaient le nombre de leurs bâillements
à leur insu. Quelles qu'elles soient, de
nombreux biais d'erreurs sont attachées
à ces méthodes.. Le
bâillement est ressenti comme
extrêmement banal, laissant le sujet
indifférent à son apparition, hors
quelques situations d'interactions sociales
où sa survenue a une connotation
péjorative. Une sous estimation est donc
possible. Reste à développer un
appareillage capable de déterminer, par
exemple l'activité des muscles
digastriques ou sous hyoïdiens, et mesurant
ainsi l'ouverture de bouche, de façon
automatique, couplé à une horloge.
Seul ce type de holter des bâillements
permettra de connaître la
réalité d'une façon
méthodologique correcte et
reproductible.
-
- Les observations suivantes peuvent
néanmoins être rapportées:
de la naissance, où ils sont très
fréquents (50 à 60 par jour),
à l'adolescence le nombre de
bâillements quotidiens diminuent (5
à 20 par jour). De l'âge adulte
à la vieillesse, le nombre de
bâillements décline
légèrement sans qu'ils ne
disparaissent jamais complètement, sauf
en cas de pathologie comme un syndrome
parkinsonien ou d'une origine iatrogène
(neuroleptiques et opiacés font
disparaître les bâillements).
-
- Le questionnaire proposé aux
visiteurs du site internet
http://www.baillement.com, rempli de
façon anonyme, ne présente pas les
critères de rigueur d'une enquête
scientifique. Son originalité provient du
nombre de réponses reçues
qu'aucune autre enquête n'a jamais
colligées. A partir de 1800
réponses, il est possible de
comptabiliser que 25% de visiteurs
bâillent moins de 5 fois par jour, 26%
bâillent de 5 à 10 fois par jour,
16% bâillent de 10 à 15 fois par
jour, 8% bâillent de 15 à 20 fois
par jour et 25% bâillent plus de 20 fois
par jour. 32% bâillent trop à leur
gré et s'en trouvent
importunés.
- Les horaires privilégiés
d'apparition du bâillement sont le matin
au réveil, alors associé à
des étirements musculaires
(pandiculation), et à l'approche de
l'endormissement, alors isolé, ainsi que
dans toutes les circonstances de baisse de la
vigilance (Provine, 1987; Greco et al, 1993).
Les travaux de sélections de
lignées de rats grands bâilleurs
type Wistar par les équipes mexicaines de
J. Anias et J. Eguibar (1984) ont montré
l'existence d'un rythme circadien,
confirmé par les enquêtes en
psychologie (Baenninger, 1996) et en
médecine générale
(Walusinski 2000). Des conditions
d'environnement, comme le confinement dans un
local de dimensions réduites et la
chaleur excessive, sont des facteurs majorant la
fréquence des bâillements
causés par l'ennui. M. Greco et R.
Baenninger (1993) ont établi que la
fréquence des bâillements est
élevée dans 4 situations de la vie
quotidienne: lire, voyager dans un transport en
commun, conduire, attendre. G. Schino et F.
Aureli (1989) ont montré, en
étudiant les voyageurs du métro de
Rome aux heures de pointe, qu'il n'existait pas
de différence de fréquence des
bâillements chez les humains de sexe
masculin ou féminin. Comme il existe des
petits et des grands dormeurs, il existe des
petits et des grands bâilleurs.
-
- Depuis la vie intra-utérine jusqu'aux
grands âges, le bâillement ne varie
pas dans son déroulement
stéréotypé. Des
désordres des articulations
temporo-mandibulaires peuvent limiter la large
ouverture de bouche. Les pandiculations
complètes du réveil semblent se
raréfier avec le vieillissement. Faut-il
attribuer ce fait aux lésions des coiffes
des épaules, limitant leur abduction? Le
ralentissement global de la motricité s'y
associe, hors de toute pathologie. Le
vieillissement modifie le rapport entre les deux
processus régulant le sommeil,
réduction du poids du processus
circadien, pression accrue du processus
homéostasique (Munch, 2005). La pression
majorée du besoin de sommeil
post-prandial en est la conséquence.
Cette sieste est suivie, comme au sortir de la
nuit, d'un fréquent
bâillement.
-
- En quoi le bâillement est-il
lié au sommeil paradoxal ?
- La phylogenèse suggère que le
repos nocturne des poïkilothermes a
probablement évolué vers le
sommeil paradoxal (REM sleep) qui est
caractérisé, chez l'adulte, par
une intense activité corticale et une
hypotonie musculaire périphérique.
Des noyaux du tronc cérébral,
situé rostralement par rapport au pont,
envoient des influx cholinergiques activateurs
vers le cortex et des influx glutamergiques
inhibiteurs vers les motoneurones de la corne
antérieure de la moelle (Luppi, 2005). A
partir de nombreuses études ayant
concerné tant le fœtus humain que
l'animal, les données recueillies
aboutissent à considérer que la
première forme de sommeil a des
caractéristiques de sommeil actif ou
agité qui représente une forme
immature de sommeil paradoxal et est encore
très prépondérant à
la naissance. Le sommeil calme, forme immature
du sommeil profond, émerge peu à
peu, à mesure que le temps en sommeil
paradoxal se réduit pendant toute
l'ontogenèse (Blumberg, 1996).
-
- Au cours de la vie intra-utérine, le
fœtus présente, initialement, une
activité motrice
désordonnée, phasique et cyclique
qui se coordonne peu à peu. Il est
possible de distinguer des périodes
d'activité et de repos ou de sommeil.
Alternent des phases d'agitation motrice
importante à tonus musculaire
élevé et des phases
d'immobilité avec aspect d'hypotonie.
L'activité motrice des membres tels les
coups de pieds, les étirements et les
secousses globales sont caractéristiques
d'une période d'éveil (de Vries,
1982). Il est ainsi possible de décrire
un cycle ultradien d'environ une heure trente:
après une période
d'immobilité, quelques secousses
myocloniques surviennent, puis un
bâillement précède une
intense activité motrice, le tout formant
une alternance sommeil - éveil
(Walusinski, 2005). Bien que la présence
de myoclonies soit plus importante en
intensité et en fréquence chez
l'enfant qu'en période de sommeil
paradoxal de l'adulte, leur similarité
avec le comportement adulte et la succession
constante à l'hypotonie suggèrent
une continuité développementale
entre les phases de sommeil du fœtus
à l'enfant et à l'adulte. La
maturation du système nerveux central,
caractérisée par sa
myélinisation, suit un parcours
caudo-rostral, depuis la mœlle puis le
tronc cérébral jusqu'aux
hémisphères. C'est pourquoi, les
mécanismes commandant le sommeil
paradoxal sont les premiers fonctionnels et les
seuls actifs initialement (Challamel 1992).
Ensuite le sommeil lent apparaît quand les
structures thalamo-corticales deviennent
matures. Le contrôle de l'activité
neuronale exercée par le sommeil
paradoxal participe du mécanisme,
activité dépendant, de maturation
fonctionnelle du cortex. Il peut être
inféré qu'au tout début de
la vie fœtale, le sommeil paradoxal (et le
bâillement?) dirige l'évolution de
la maturation corticale par activation
neuronale, synaptogenèse et
sécrétions de neurotrophines
(Kobayashi, 2004; Valatx, 2004).
-
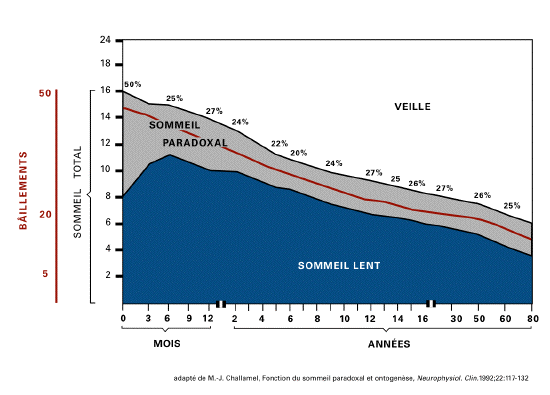
- De la vie prénatale à la vie
postnatale, un pattern comportemental montre un
développement parallèle de
l'ontogenèse du sommeil paradoxal et du
bâillement. Alors que la durée du
sommeil paradoxal décline de 50% du temps
de sommeil, chez le nouveau-né à
moins de 20% chez l'adulte, le nombre de
bâillements passe de 30 à 50 par
jour, chez le fœtus de plus de 23 semaines
et le nouveau né, à moins de 20
par jour chez l'adulte. Cette diminution
intervient essentiellement de la naissance
à la fin de la puberté (Salzarulo,
1999; Giganti, 2002).
-
- Le temps global de sommeil décline
progressivement au cours de la vie, en changeant
sa répartition circadienne comme celle de
la température et de
sécrétions hormonales
(mélatonine, GH). C'est le temps
passé en sommeil lent profond qui
décline principalement et davantage chez
l'homme que chez la femme. Le mécanisme
envisagé est une perte de la
densité en synapses corticales
fonctionnelles. La proportion de temps
passé en sommeil paradoxal par rapport au
temps total de sommeil reste stable tout au long
de la vie (Turek, 1999). La persistance de
bâillements au cours de la vieillesse
permet de confirmer le parallélisme de
l'évolution entre sommeil paradoxal et
bâillement tout au long de la vie
(Walusinski, 2005). A noter, enfin,
qu'expérimentalement, chez le rat, la
suppression du sommeil paradoxal provoque des
changements comportementaux
caractérisés par une augmentation
de l'agressivité et une disparition des
bâillements (Hipolide, 1995).
-
- C. Saper et TC. Chou (2001) proposent un
modèle d'interactions réciproques
entre les systèmes neuronaux
d'éveil et d'endormissement, un peu comme
un interrupteur de type va et vient. Ce
modèle permet d'appréhender la
rapide transition constatée de
l'éveil au sommeil lent profond et de la
sortie du sommeil paradoxal à
l'éveil. Cette capacité
apparaît comme une nécessité
pour la survie en autorisant, d'une part, un
repos réparateur, et d'autre part, la
fuite rapide face à un prédateur
(éveil). Cette transition est sous le
contrôle des structures autonomiques qui
agissent de façon intégrée
et avec une capacité d'anticipation
(mémoire émotionnelle). Le
bâillement peut s'interpréter comme
un comportement (une partie de la pandiculation)
témoignant de cette étape
transitionnelle entre les états de
sommeil et d'éveil, c'est-à-dire
un mécanisme de renforcement du tonus
musculaire. L'éveil est sous la
dépendance de quatre circuits neuronaux
redondants situés dans le pont
(adrénergique), dans le pédoncule
(dopaminerqiue), dans l'hypothalamus
(histaminergique), dans la région
basi-frontale de Meynert (cholinergique). Le
système permissif contrôlant
l'éveil doit être stimulé de
façon tonique et permanente par le
système à hypocrétines de
l'hypothalamus latéral (son
déficit est la cause de la narcolepsie).
A l'opposé, l'activation des neurones du
noyau VLPO de l'hypothalamus antérieur,
en regard du chiasma optique, induit
l'entrée en sommeil profond (Pace-Schott,
2002; Luppi, 2005). La puissante contraction
musculaire que représente le
bâillement stimule par rétroaction
les zones de la réticulée du tronc
cérébral impliquées dans
l'éveil (locus cœruleus). Lors de
l'éveil, bâillement et
pandiculation inversent l'hypotonie musculaire
qui caractérise le sommeil paradoxal,
ouvrent largement les voies respiratoires
pharyngo-laryngées. Quand la pression de
sommeil augmente, il est supposé que
l'activation des neurones gabaergiques et
galaninergiques du VLPO diminuent le tonus des
muscles anti-gravitaires, notamment ceux de la
nuque et des masséters que le
bâillement inverserait.
-
- A l'acmé du bâillement, la
pression intra-thoracique est à son
maximum. Le diaphragme est brièvement
immobile. Ces phénomènes
engendrent un blocage du retour veineux et ainsi
une hyperpression dans les sinus veineux
intracrâniens. L'expiration passive qui
suit inverse ces pressions. Il en résulte
une variation parallèle de la pression du
liquide céphalo-rachidien avec
accélération de sa circulation. Il
est émis l'hypothèse d'une
augmentation de la clairance de facteurs
hypnogènes présents dans le LCR,
tels l'adénosine et la prostaglandine D2,
ce qui réduirait la pression de sommeil
(Luppi, 2005). Il n'existe pas de données
validant cette hypothèse et
précisant l'éventuel effet du
vieillissement.
-
- Bâillements et pathologies de la
sénescence.
- Le vieillissement physiologique
s'accompagne, de façon plus ou moins
rapide et importante, d'une locomotion ralentie,
d'une difficulté d'apprentissage de
nouveaux automatismes gestuels qui semblent en
rapport avec la réduction de
l'activité des neurones dopaminergiques
et une suractivité galaninergique (Floel,
2005). La réduction de la
fréquence quotidienne des
bâillements est corrélée
à cet état (Stoessl, 1989). Un
spectre moteur s'établit du sénior
actif et à mobilité
coordonnée préservée qui
bâillent 5 à 20 fois par jour
jusqu'à la maladie de Parkinson à
motricité lente, voire bloquée et
au cours de laquelle les bâillements
disparaissent. Les agonistes dopaminergiques
restaurent la motricité. L'apparition de
bâillements est souvent le premier signe
du déblocage attendu par le parkinsonien
ayant reçu une injection d'apomorphine
(Blin, 1990; Goren, 1998; Dewey, 2001).
-
- Alors que les opiacés font
disparaître les bâillements, leur
sevrage est suivi d'un rebond du nombre de
bâillements. L'accroissement de l'usage
d'antalgiques opiacés dans la pratique
quotidienne, notamment en rhumatologie, a fait
naître une nouvelle forme de
bâillements iatrogènes. La mise sur
le marché d'une association tramadol -
paracétamol, largement promue dans des
indications de douleurs arthrosiques, est
à l'origine de salves de
bâillements témoignant d'un
syndrome de sevrage de fin de doses. La prise
régulière d'un comprimé
matin et soir est responsable, après
quelques semaines d'usage, de bâillements
et d'une réapparition des douleurs
lorsque la dose préconisée,
supposée agir pour 12 heures, est en fait
métabolisée plus rapidement et que
les prises sont effectivement espacées de
12 heures (Freye, 2000; Sommet, 2005).
-
- Les états dépressifs sont
fréquents, souvent favorisés par
la solitude et l'isolement des personnes
âgées. Les antidépressifs
sérotoninergiques ont acquis la faveur
des prescripteurs en raison d'une moins grande
toxicité, supposée,
comparée à celle des tricycliques.
Actuellement, cette classe pharmacologique est
la plus fréquemment retrouvée
comme cause de bâillements
iatrogènes, survenant par salves de 15
à 30 bâillements successifs se
répétant plusieurs fois par heure
de l'éveil à l'endormissement.
Face à cet état fréquemment
interprété comme témoignage
de la persistance d'une asthénie
dépressive, les praticiens ont parfois
tendance à majorer les doses prescrites,
alors que seul l'arrêt fait
disparaître la gêne qu'ils
occasionnent (Beale, 2000; Sommet, 2005).
-
- Au même titre qu'il est
impliqué dans les mécanismes de
l'éveil, le système cholinergique
est la voie finale exécutive du
bâillement (Argiolas, 1998). C'est
peut-être là une explication de
l'augmentation du nombre des bâillements
pouvant s'observer chez les malades
traités pour maladie d'Alzheimer, par
agonistes cholinergiques (Ogura, 2001;
Walusinski, 2004). Une autre explication
peut-être proposée: la
dégénérescence et la perte
neuronales influencent non seulement les
capacités cognitives mais aussi les
régulations homéostasiques
diencéphaliques (Hof, 2004). Cette
atteinte est la source de troubles du rythme
veille - sommeil et de la durée de ces
périodes. Les excès de somnolence
s'accompagnent, aux stades évolutifs
avancés, de bâillements
répétés, que la perte
mnésique des convenances sociales
n'inhibent plus, et d'apnées du sommeil
d'origine centrale (Gozal, 2005).
-
- Le bâillement au cours des accidents
vasculaires cérébraux: à la
phase aigue constitutive et dans les premiers
jours d'évolution d'un accident,
hémorragique ou ischémique, les
salves de bâillements sont
extrêmement fréquentes. S'il existe
un coma, des irrégularités du
rythme ventilatoire associé à des
bâillements, il est urgent de rechercher
un processus d'engagement par hypertension
intracrânienne (Crosby, 1989; Bateman,
2001). Lorsqu'il existe une lésion
corticale et des voies thalamo-corticales, il
est proposé d'interpréter ces
bâillements comme une
extériorisation comportementale de
l'activité de la réticulé
ascendante du tronc cérébral et de
son action stimulante de l'éveil
(déficit de feed-back par lésion
des voies descendantes?). Ce mécanisme
est aussi proposé pour expliquer les
bâillements qui apparaissent au
décours d'une crise d'épilepsie,
notamment dans les formes partielles temporales
(Meletti, 2003; Medrano, 2005). A la
période de lésions
constituées non évolutives, il
faut noter la persistance de bâillements
possibles au cours du "locked in syndrome" et du
syndrome bioperculaire de Foix-Chavany,
témoignage de la dissociation automatico
volontaire. Enfin, nous avons baptisé
parakinésie brachiale oscitante
(Walusinski, 2005) le curieux
phénomène, parfois
rencontré au cours
d'hémiplégies
sévères, où le bras
totalement paralysé s'élève
et se porte vers la bouche pendant la
durée stricte du bâillement.
-
- La ronchopathie sonore et le syndrome
d'apnées du sommeil, d'origine centrale
ou obstructive, sont des pathologies
fréquentes, dont la prévalence
augmente avec l'âge. Source et part de
co-morbidité, le diagnostic n'en est
souvent pas facile. Quand l'hypertension
artérielle, la pollakiurie, les
céphalées, les déficits
cognitifs paraissent au premier plan,
l'existence d'une plainte d'asthénie
chronique, de sommeil non réparateur
associée à des bâillements
excessifs répétés, tout au
long de la période d'éveil, avec
ou sans somnolence diurne associée, doit
faire évoquer ce diagnostic (Planchard,
2004; Groth, 2005).
-
- Souvent négligée, parmi les
symptômes climatériques, la plainte
asthénique présente de
fréquentes analogies avec les signes
d'une pathologie d'apnées du sommeil
(Hall, 2005). Il peut, là aussi, exister
des bâillements anormalement
fréquents, attribués à une
dette de sommeil secondaire à sa
fragmentation par des éveils
déclenchés par les bouffées
de chaleur. L'hyperandrogénie relative
peut s'y ajouter. En effet,
expérimentalement, la progestérone
et les œstrogènes inhibent les
bâillements alors que la
testostérone en augmente la
fréquence, rappelant les
bâillements
testostérone-dépendants, propres
aux mâles dominant chez certains primates
(Holmgren, 1980; Deputte, 1994).
-
- Contrairement à une opinion trop
répandue, la fréquence des
céphalées et de la migraine en
particulier, ne diminue pas avec le
vieillissement (Chatap, 2004). La migraine est
secondaire à la combinaison de facteurs
environnementaux et génétiques. Un
dysfonctionnement hypothalamique a un rôle
central dans sa physiopathologie (Peres, 2001).
La clinique, comme la pharmacologie et de
récents développements de la
génétique, confirment
l'hypothèse qu'un dysfonctionnement de la
transmission dopaminergique interviendrait dans
la physiopathologie de la crise migraineuse
(Fanciullacci, 2000). Les prodromes (changements
d'humeur, bâillements, somnolence,
dégoût alimentaire) et les
post-dromes (changements d'humeur,
bâillements, somnolence, lassitude)
peuvent être reliés à une
sur-stimulation dopaminergique expliquant
l'accroissement du nombre des bâillements
chez les migraineux (Blau, 1991). Le
système dopaminergique joue aussi un
rôle à la phase douloureuse, d'une
part en participant aux voies nociceptives,
d'autre part en intervenant dans la
régulation de la circulation
artérielle cérébrale.
L'apomorphine induit plus de bâillements
chez les migraineux que chez les non-migraineux,
ainsi que d'autres symptômes tels les
nausées, les vomissements et les
étourdissements (Blin, 1991).
-
- Efin, le bâillement peut
lui-même être source de pathologies.
Il peut déclencher une crise de
névralgie du glossopharyngien (Minagar,
2000), être la gâchette d'un
syndrome de Charlin-Sluder (Lagares, 2005). Il
est la cause la plus fréquente de la
luxation de de l'articulation
temporo-mandibulaire (Mercier, 1997) et de la
fracture de l'apophyse styloïde (McCorkell,
1985).
-
- Conclusion.
- Alors que les mécanismes intimes qui
président au déclenchement du
bâillement restent à
élucider, il semble pertinent de
considérer son étude comme un
modèle de ce qu'on pourrait baptiser une
archéologie des comportements. En effet,
sa précocité
ontogénétique, son
ancienneté phylogénétique,
son universalité chez les
vertébrés des mondes
aériens, terrestres et sous marins, son
association aux mécanismes
homéostasiques des trois fondements de la
Vie (rythme veille-sommeil, alimentation,
sexualité), la persistance de son aspect
stéréotypé, resté
inchangé au regard des lois de
l'Evolution, renvoient aux prémices de la
vie des vertébrés. Présent
chez l'Homme, depuis la vie intra-utérine
jusqu'à la mort, le bâillement
reste inchangé dans son
déroulement et ne vieillit donc pas.
Seule sa fréquence se modifie. Le nombre
de bâillements quotidiens diminue de
façon parallèle à la
réduction du temps de sommeil.
-
- Le bâillement extériorise
chaque jour l'activité de la partie
phylogénétiquement reptilienne, la
plus archaïque, du cerveau (Striedter,
2005). Alors pourquoi négliger la valeur
sémiologique qui y est attachée
?
-
- Remerciements
- Jean-Philippe Neau (neurologie, CHU
Poitiers) et Piero Salzarulo (Università
di Firenze) ont relu ce texte.
-
- Références
-
- Abadie (V.), Champagnat (J.), Fortn (G.),
Couly (G.). Succion, déglutition,
ventilation et gènes du
développement du tronc
cérébral. Arch Ped.
1999;6:1043-1047.
-
- Anias (J.), Homgren (B.), Holmgren (U.),
Eguibar (J.-R.). Circadian variation of yawning
behavior. Acta Neurobiol Exp.
1984;44(4):179-186.
-
- Argiolas (A.), Melis (R.-M.). The
neuropharmacology of yawning. Europ J.
Pharmacol. 1998;343(1):1-16.
-
- Aubin (H.-J.), Garma (L.). Le
bâillement. Psychiatr & Psychobiol.
1988;3:275-286.
-
- Baenninger (R.), Binkley (S.), Baenninger
(M.). Field observations of yawning and activity
in humans. Physiol Behav.
1996;59(3):421-425.
-
- Baenninger (R.). On yawning and its
functions. Psychonomic Bul Rev.
1997;4(2):198-207.
- Barbizet (J.). Le bâillement. Concours
Med. 1958;80(5):537-548.
-
- Bateman (D.E.). Neurological assessment of
coma. J. Neurol Neurosurg Psychiatry.
2001;71(Suppl 1):i13-17.
-
- Beale (M.-D.), Murphree (T.-M.). Excessive
yawning and SSRI therapy. Int. J.
Neuropsychopharmacol. 2000;3(3):275-276.
-
- Blau (J.-N.). Migraine postdromes: symptoms
after attacks. Cephalalgia.
1991;11(5):229-231.
-
- Blin (O.), Masson (G.), Azulay (J.-P.),
Fondarai (J.), Serratrice (G.).
Apomorphine-induced blinking and yawning in
healthy volunteers. Br. J. Clin Pharmacol.
1990;30(5):769-773.
-
- Blin (O.), Azulay (J.-P), Masson (G.),
Aubrespy (G.), Serratrice (G.).
Apomorphine-induced yawning in migraine
patients: enhanced responsiveness. Clin.
Neuropharmacol. 1991;14(1):91-95.
-
- Blumberg (M.-S.), Luca (D.-E.). A
developmental and component analysis of active
sleep. Develop Psychobiol. 1996;29(1):1-22.
-
- Challamel (M.-J.). Fonctions du sommeil
paradoxal et ontogenèse. Neurophysiol.
Clin. 1992;22(2):117-132.
-
- Chatap (G.), Giraud (K.), Vincenti (J.-P.).
Céphalées du sujet
âgé. La Presse Médicale.
2004;33(12C1):808-818.
-
- Chouard (C.-H.), Bigot-Massoni (D.).
Mécanismes et rôle physiologique du
bâillement. Ann Otolaryngol Chir
Cervicofaciale. 1990;107(3):145-153.
-
- Crosby (L,.) Parsons (L.-C). Clinical
neurologic assessment tool: development and
testing of an instrument to index neurologic
status. Heart Lung. 1989 Mar;18(2):121-129.
-
- Daquin (G.), Micaleff (J.), Blin (O.).
Yawning. Sleep Med. Rev. 2001;5(4):299-322.
-
- Deputte (B.-L.), Johnson (J.), Hempel (M.),
Scheffler (G.). Behavioral effects of an
antiandrogen in adult male rhesus macaques
(Macaca mulatta). Horm. Behav.
1994;28(2):155-164.
-
- de Vries (J.-I.), Visser (G.-H.), Prechtl
(H.-F.). The emergence of fetal behaviour. Early
Hum. Dev. 1982;7:301-322.
-
- Dewey (R.-B. Jr.), Hutton (J.-T.), LeWitt
(P.-A.), Factor (S.-A.). A randomized,
double-blind, placebo-controlled trial of
subcutaneously injected apomorphine for
parkinsonian off-state events. Arch. Neurol.
2001;58(9):1385-1392.
-
- Fanciullacci (M.), Alessandri (M.), Del
Rosso (A.). Dopamine involvement in the migraine
attack. Funct. Neurol. 2000;15(Suppl
3):171-181.
-
- Floel (A.), Breitenstein (C.), Hummel (F.),
Celnik (P.), Gingert (C.), Sawaki (L.), Knecht
(S.), Cohen (L.-G.). Dopaminergic influences on
formation of a motor memory. Ann Neurol.
2005;58(1):121-130.
-
- Fraser (A.-F.). Pandiculation: the
comparative phenomenon of systematic stretching.
Appl. Anim. Behav. Sci. 1989;23:263-268.
-
- Freye (E.), Levy (J.). Acute abstinence
syndrome following abrupt cessation of long-term
use of tramadol: a case study. Europ. J. Pain.
2000;4(3):307-311.
-
- Giganti (F.), Hayes (M.-J.), Akilesh (M.-R.)
et al. Yawning and behavioral states in
premature infants. Development Psychobiol.
2002;41(3):289-293.
-
- Goren (J.-L.), Friedman (J.-H.).Yawning as
an aura for an L-dopa-induced "on" in
Parkinson's disease. Neurology.
1998;50(3):823.
-
- Gozal (D.), Kheirandish (L.).Sleepiness and
neurodegeneration in sleep-disordered breathing:
convergence of signaling cascades. Am. J.
Respir. Crit. Care Med.
2005;171(12):1325-1327.
-
- Greco (M.), Baenninger (R.). Selfreport as a
valid measure of yawning in the laboratory.
Bull. Psychonomic. Soc. 1989;27:75-76.
-
- Greco (M.), Baenninger (R.). Effects of
yawning and related activities on skin
conductance and heart rate. Physiol. Behav.
1991;50(5):1067-1069.
-
- Greco (M.), Baenninger (R.), Govern (J.). On
the context of yawning: when, where, and why?
Psych. Rec.1993;43:175-183.
-
- Groth (M.). Sleep Apnea in the Elderly.
Clin. Geriatr. Med. 2005;21(4):701-712.
-
- Hall (M.-N.), Leach (L.), Kynerd (R.). In
menopausal women, does fatigue indicate disease?
J. Fam. Pract. 2005;54(10):895-896.
-
- Hipolide (D.-C.), Tufik (S.). Paradoxical
sleep deprivation in female rats alters
drug-induced behaviors. Physiol. Behav.
1995;57(6):1139-1143.
-
- Holditch-Davis (D.), Brandon (D.-H.),
Schwartz (T.). Development of behaviors in
preterm infants: relation to sleeping and
waking. Nurs. Res. 2003;52(5):307-317.
-
- Hof (P.-R.), Morrison (J.-H.). The aging
brain: morphomolecular senescence of cortical
circuits. Trends Neurosci.
2004;27(10):607-613.
-
- Holmgren (B.), Urba-Holmgren (R.), Aguiar
(M.), Rodriguez (R.). Sex hormone influences on
yawning behavior. Acta. Neurobiol. Exp. (Wars).
1980;40(2):515-519.
-
- Kobayashi (T.), Good (C.), Mamiya (K.), et
al. Development of REM sleep drive and clinicals
implications. J. Appl. Physiol.
2004;96:735-746.
-
- Lagares (A.), Gomez (P.-A.), Perez-Nunez
(A.), Lobato (R.-D.), Ramos (A.). Short-lasting
unilateral neuralgiform headache with
conjunctival injection and tearing syndrome
treated with microvascular decompression of the
trigeminal nerve: case report. Neurosurgery.
2005;56(2):E413.
-
- Luppi (P.-H). Sleep, circuits und functions.
Boca Raton CRC Press. 2005.
-
- McCorkell (S.). Fractures of the styloid
process and stylohyoid ligament: an uncommon
injury. J. Trauma. 1985;25(10):1010-1012.
-
- Medrano (V.), Selles-Galiana (M.-F.),
Fernandez-Izquierdo (S.), Mallada-Frechin (J.),
Diaz-Gonzalez (F.), Piqueras-Rodriguez (L.).
Yawning and temporal lobe epilepsy. Rev. Neurol.
[Article in Spanish].
2005;41(1):63-64.
-
- Meletti (S.), Cantalupo (G.),
Stanzani-Maserati (M.), Rubboli (G.), Alberto
Tassinari (C.). The expression of interictal,
preictal, and postictal facial-wiping behavior
in temporal lobe epilepsy: a neuro-ethological
analysis and interpretation. Epilepsy Behav.
2003;4(6):635-643.
-
- Mercier (J.), Huet (P.), Piot (B.), Taiariol
(L.). La luxation de l'articulation
temporo-mandibulaire. Rev. Prat. Méd.
Gén.1997;11(389):25-28.
-
- Minagar (A.), Sheremata (W.-A.).
Glossopharyngeal neuralgia and MS. Neurology.
2000;54(6):1368-1370.
-
- Munch (M.), Knoblauch (V.), Blatter (K.),
Schroder (C.), Schnitzler (C.), Krauchi (K.),
Wirz-Justice (A.), Cajochen (C.). Age-related
attenuation of the evening circadian arousal
signal in humans. Neurobiol. Aging.
2005;26(9):1307-1319.
-
- Ogura (H), Kosasa (T), Kuriya (Y), Yamanishi
(Y). Central and peripheral activity of
cholinesterase inhibitors as revealed by yawning
and fasciculation in rats. Eur. J. Pharmacol.
2001;415(2-3
|


