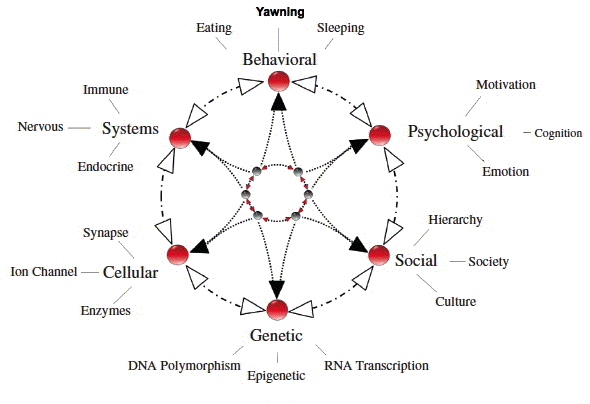
- Abstract
: Stretching and yawning (the association has
gone identified as pandiculation) are neglected
features among categories of maintenance
behavior. Arising in the common ancestors of all
vetebrates, systematic and coordinated
pandiculations occur in a compound pattern of
almost identical general form among them, during
the transition's behaviors occuring with
different cyclic life's rhythms: sleep-arousal,
feeding and reproduction. This kinesis appears
as one undirected response to an inner
stimulation, underlying the homeostasis of these
three behaviors. By explaining the specific
regulatory strategies and the neural networks
involved, it is proposed that yawning is a part
of interoceptiveness by its capacity to increase
arousal and self-awareness. Hominids have the
unique capacity to be receptive to the
contagiousiness of yawning. Yawning appear to
trigger a sort of social coordination function
(arousal synchrony) and reflect the capacity to
unconsciously, automatically be influenced by
the behaviour of others, supporting the
hypothesis that contagious yawning share the
neural networks involved in empathy.
-
- Pourquoi
bâillons-nous ? Revue des théories
d'Hippocrate à nos jours Walusinski O
2014
-
- Résumé
: Bâiller et s'étirer
(l'association se nomme une pandiculation) sont
des comportements ayant reçus peu
d'attention alors qu'ils témoignent de
processus adaptatifs d'homéostasie
fondamentaux pour la Vie. Déjà
présentes chez les
vertébrés
phylogénétiquement les plus
anciens, les pandiculations
généralisées et
coordonnées se développent, de
façon morphologiquement semblable chez
tous les vertébrés, lors des
transitions comportementales, survenant de
façons récurrentes et cycliques au
cours des trois rythmes biologiques bases de la
Vie: l'alternance veille-sommeil, la
régulation de la satiété et
la sexualité. Cette activité
neuro-musculaire répond à une
stimulation interne, sans raison
extériorisée appréhendable,
mais nécessaire aux processus
d'homéostasie des ces trois
comportements. Après avoir
explicité les mécanismes
neurobiologiques activés et les circuits
neuronaux qui les sous tendent, il est
proposé d'interpréter
bâillements et pandiculations comme
participant de l'intéroception par leurs
capacités à stimuler
l'éveil et la perception consciente du
schéma corporel. D'autres part, le
bâillement joue un rôle dans la vie
sociale par sa capacité à
synchroniser les niveaux d'éveil entre
individus. Sa contagion ou
échokinésie reflète notre
faculté à être
influencés par le comportement d'autrui
de façon automatique et involontaire. Il
est proposé que
l'échokinésie du bâillement
est une forme d'empathie instinctive
involontaire avec laquelle il partage les
structures neurofonctionnelles corticales.
-
- Sumario
: Nos proponemos señalar cómo
las pandiculaciones &endash; combinaciones de
bostezar y estirarse que permanecen
morfologicamente idénticas en todas las
clases de vertebrados &endash; se asocian con
estados de transición entre las fases de
ritmos biológicos, tanto infradianos y
circadianos cuanto ultradianos. Los
comportamientos de bostezo solo y de
pandiculación han recibido poca
atención, aunque testimonian procesos
homeostásicos adaptativos que son
indispensables para la vida. Se trata de
kinesias o composiciones unitarias de actividad
neuromuscular; esto implica, en cuanto a su
puesto en la serie de adquisiciones
neurobiológicas mayores, que siguen a la
integración de ciclos bioquímicos
en ritmos biológicos y preceden a la
adquisición de praxias, gnosias y
simbolias. Habiendo así surgido
presumiblemente en antepasados comunes a todos
los vertebrados y presentes ya en los
vertebrados filogeneticamente más
antiguos, en todas las clases de vertebrados las
pandiculaciones generalizadas y coordinadas se
ejecutan de modo morfologicamente similar, en
ocasión de transiciones comportamentales
que de manera recurrente y cíclica tienen
lugar en el curso de los tres tipos de ritmos
biológicos que sostienen el estilo de
vida del tipo vertebrado: a saber, la
alternancia vigilia-sueño, la
regulación de la saciedad y las
regularidades reproductivas. Esta kinesia, la
pandiculación, responde a una
estimulación interna, que no exterioriza
razón visible pero es necesaria para los
procesos de la homeostasis en esas tres
áreas de comportamiento. En el presente
trabajo, tras haber explicitado los mecanismos
neurobiologicos activados y los circuitos
neuronales que los sostienen, se propone
interpretar bostezos y pandiculaciones como
participantes de la interoception, o introyente
de Chr. Jakob, por sus capacidades de estimular
la vigilia así como la saliencia, noergia
o nivel de percepción consciente del
esquema corporal. Los Homininos compartimos una
aptitud particular, la de ser receptivos a la
contagiosidad del bostezo. Con ello el bostezo
humano juega un rol en la vida social, por su
poder de sincronizar los niveles de vigilia
entre varios individuos. Su ecoquinesia o
contagio refleja nuestra capacidad de ser
influenciados por el comportamiento de otro de
manera automática e involuntaria. Se
propone aquí que la ecoquinesia del
bostezo es una forma de empatía
kinésica, por lo tanto instintiva e
involuntaria, que pone en juego estructuras
neurofuncionales corticales compartidas
-
« The muscular fibres
themselves constitute the organ of sense, that
feels extension... hence the whole muscular
system may be considered as one organ of sense,
and the various attitude of the body, as ideas
belonging to this organ, of many of which we
have hourly conscious, while many others, like
the irritative ideas of the other senses, are
performed without our attention.»
- Erasmus
Darwin,
Zoonomia
(1801).
-
- «
L'accomplissement d'une action n'est qu'une
forme de représentation mentale, et dans
les conditions psychologiques normales,
l'idée du mouvement d'un membre c'est
déjà le
mouvement.»
- Jean
Martin Charcot
-
- Les organismes vivants, en particulier les
vertébrés, exhibent des
comportements variés, essentiels à
leur survie, caractérisés par leur
récurrence cyclique. Il en va ainsi pour
les trois comportements fondamentaux de la vie
et de sa transmission: la vigilance (être
apte à survivre face aux
prédateurs alors que le sommeil est
indispensable à l'homéostasie du
cerveau), l'alimentation (capter de
l'énergie), la sexualité
(transmettre la vie). Cette rythmicité
répond aux critères définis
par Bejan
et Marden (2006) dans leur "théorie
constructale" des périodicités
naturelles et notamment biologiques. Nous nous
proposons de montrer comment les
bâillements et les pandiculations, en
restant morphologiquement identiques,
apparaissent associés à chaque
état transitionnel des rythmes
infradiens, circadiens, ultradiens qui
caractérisent ces comportements.
-
- Que sont des bâillements et des
pandiculations ?
-
- L'éthologie agrée
l'idée que la plupart des
vertébrés bâillent qu'ils
soient poïkilothermes ou
homéothermes, des mondes sous-marins,
terrestres ou aériens, herbivores,
fructivores, insectivores ou carnivores.
L'existence de bâillements chez les
reptiles confirme l'origine
phylogénétiquement ancienne de ce
comportement. Sa survivance, sans variation
évolutive, indique son importance d'un
point de vue fonctionnel.
-
- Une pandiculation est un bâillement se
déroulant simultanément à
une contraction massive des muscles
antigravifiques (André-Thomas,
1949), c'est à dire une extension maximum
des quatre membres et du rachis, portant en
arrière la tête.
- Pendant le bâillement, le plus grand
muscle de l'organisme, le diaphragme, se
contracte massivement provoquant une ample
inspiration par des voies aériennes
supérieures ouvertes à
l'extrême ainsi que la bouche. J.
Barbizet
(1958) a montré que le diamètre du
pharyngo-larynx est multiplié par quatre
par rapport à la position de repos. La
contraction simultanée des muscles
ouvrant la bouche (mylo-hyoïdiens et
digastriques) et de ceux assurant sa fermeture
(ptérygoïdiens, masséters,
temporaux), explique les contraintes importantes
subies alors par les articulations
temporo-mandibulaires (Forte,
1982). Les mouvements de la tête font
partie intégrante du cycle
ouverture/fermeture de la bouche
nécessaire à la mastication,
à l'élocution, au chant, mais
aussi au bâillement (Abrahams, 1988,
1993).
D'un point de vue phylogénique, chez
toutes les espèces, ce couplage
fonctionnel a une valeur adaptative,
sélectionnée, car elle assure une
meilleure capacité à saisir des
proies mais aussi à se défendre et
à combattre. Les afférences
sensori-motrices oro-faciales (trijumeau) sont
nécessaires au contrôle de la
motricité cervico-céphalique,
c'est à dire que l'activité
fonctionnelle mandibulaire est une association
de mouvements synchronisés de la nuque et
de la mâchoire dans lesquels interviennent
les articulations temporo-maxillaires, le rachis
cervical et sa musculature (Zafar,
2000). L'action des muscles masséters et
cervicaux est synchronisée par une
commande motrice commune automatique
générée par le tronc
cérébral, ("Central pattern
generating circuits" Marder, 2005) où
siègent les noyaux moteurs des paires
crâniennes V, VII, IX, X, XI, XII. Toutes
ces structures motrices sont activées
pendant les bâillements. T. Humphrey
(1968) a parlé d'un réflexe
trijémino-nuqual.
-
- A partir de ce concept de lien entre
activité motrice cervicale et
mandibulaire, un appareillage a
été développé afin
d'assurer le dépistage ambulatoire du
syndrome des apnées du sommeil (Somnolter©).
En effet, la fin d'une apnée obstructive
ou centrale est suivie d'un micro-éveil,
d'un mouvement d'ouverture de bouche
d'inspiration, mettant fin à un
arrêt ventilatoire avec éventuelle
désaturation artérielle en O2. Le
Somnolter permet ainsi l'estimation de la
distance intermaxillaire et, en corollaire,
permet d'enregistrer les bâillements. Il
est noté que l'amplitude d'ouverture de
la bouche, lors d'un bâillement
spontané, est plus importante que
l'ouverture volontaire maximale de la bouche
lors du calibrage de l'appareil et que
l'occlusion qui suit la fin du bâillement
apparaît également plus
accentuée que l'occlusion volontaire.
C'est la première méthode
permettant de compter, de façon
objective, le nombre de bâillements.
-
- L'ensemble des données
présentées autorise à
décrire le bâillement comme une
pandiculation partielle, c'est à dire une
contraction massive du diaphragme, des muscles
de la face et de la nuque, sans contraction des
extenseurs des membres et du rachis
dorso-lombaire. V. Dumpert
et E. Claparède
avaient déjà proposé, en
1921, cette interprétation qui permet
d'apporter une explication neurophysiologique
à ce comportement.
-
- Neurophysiologie des bâillements et
pandiculations
-
- Les transitions comportementales des animaux
ne résultent pas d'une adaptation passive
aux conditions d'environnement mais
obéissent à des stimuli internes
caractérisant les adaptations
homéostasiques
générées, en particulier,
par l'hypothalamus (noyaux suprachiasmatiques,
noyaux paraventriculaires). Ces horloges
biologiques internes autorisent une
adéquation précise entre besoins
métaboliques (satiété),
survie de l'espèce (accouplement) et
conditions d'environnement (adaptation tonique
à la pesanteur et motricité). Les
bâillements et les pandiculations sont
associés aux transitions entre des
états d'éveil et de sommeil, lors
de l'installation de la faim ou de la
satiété, lors de l'installation ou
de la disparition d'états
émotionnels secondaires à une vie
en groupes sociaux hiérarchisés
(Walusinski,
2004).
-
- C. Sherrington
(1905) a énoncé le paradigme que
seule l'activité motrice
extériorise l'activité du
système nerveux. Bâillements et
pandiculations extériorisent
l'activité des centres moteurs du tronc
cérébral (V, VII, IX, X, XI, XII.)
et de la moelle, sous la commande du noyau
paraventriculaire de l'hypothalamus (PVN). Le
PVN est un centre d'intégration entre les
systèmes autonomes central et
périphérique. Il intervient,
notamment, dans la balance métabolique
(osmolarité, énergie), la pression
artérielle et la fréquence
cardiaque, la sexualité.
Bâillements et pandiculations peuvent
être déclenchés par des
injections (apomorphine, hypocrétines,
etc) ou disparaître après
électrolésion dans la zone
parvo-cellulaire du PVN
(Sato-Suzuki,
1998). Un groupe de neurones ocytocinergiques,
situés dans cette zone du PVN, projetant
vers l'hippocampe, le tronc
cérébral (locus coeruleus) et la
moelle, contrôlent les bâillements
et l'érection. La stimulation de ces
neurones par la dopamine ou ses agonistes, des
acides aminés excitateurs (NMDA),
l'ocytocine elle-même, déclenche
des bâillements alors que le GABA ou les
opioïdes inhibent bâillements et
érections. L'activité de ces
neurones dépend d'une enzyme la "nitric
oxyde synthetase" qui fabrique l'oxyde nitrique
à l'origine de la libération de
l'ocytocine par un mécanisme actuellement
non élucidé.
-
- Par opposition à l'éveil, le
sommeil est un état comportemental
caractérisé par un
désengagement sensoriel avec
l'environnement et les perceptions internes
(intéroception). Des cycles successifs de
60 à 90 minutes se renouvellent au cours
d'une nuit de sommeil, avec succession de
sommeil lent profond (prédominant en
début de nuit) et de sommeil paradoxal
(prédominant en fin de nuit). Celui-ci
est caractérisé par une
activité corticale comparable à
l'éveil, accompagnée d'une
hypotonie musculaire périphérique
avec collapsus relatifs des voies respiratoires
supérieures, une instabilité des
processus végétatifs autonomes
rappelant l'état poïkilotherme.
L'éveil spontané survient
préférentiellement lors du
début de la remontée de la
température corporelle (rythme
circadien), en fin d'une période de
sommeil paradoxal (Campbell,
1985). La transition vers l'éveil
comporte une reprise des processus sensoriels,
facilitée par l'activité corticale
rapide de cette phase de sommeil, et
s'accompagne d'une reprise du tonus musculaire
tant au niveau squelettique qu'au niveau des
voies aériennes supérieures.
Bâillements et pandiculations ouvrent les
voies respiratoires et renforcent le tonus
musculaire antigravifique. Toute activité
motrice génère un
rétro-contrôle (feedback)
adaptatif. La puissante contraction musculaire
du bâillement et de la pandiculation
génère une information sensorielle
en retour, par les voies de la
sensibilité profonde, projetant sur le
locus coeruleus (boucles sensori-motrices
trijémino-cervico-spinales), la
réticulée ascendante du tronc
cérébral et l'hypothalamus
latéral. Il est proposé
d'expliquer la finalité de ces
comportements comme une stimulation des
systèmes d'éveil (système
noradrénergique et dopaminergique
projettant vers le cortex) et un renforcement du
tonus musculaire (système hypothalamique
hypocrétinergique), engendrée par
ce rétro-contrôle (Walusinski,
2006).
-
- Les états d'éveil et de
sommeil correspondent à des
activités de circuits neuronaux
spécifiques. Bâillements et
pandiculations peuvent être
interprétés comme un
mécanisme adaptatif déconnectant
un type de circuit neuronal et favorisant la
mise en fonction d'un autre réseau
("reset" ou reconfiguration), optimisant le
changement comportemental (Bouret,
2005).
-
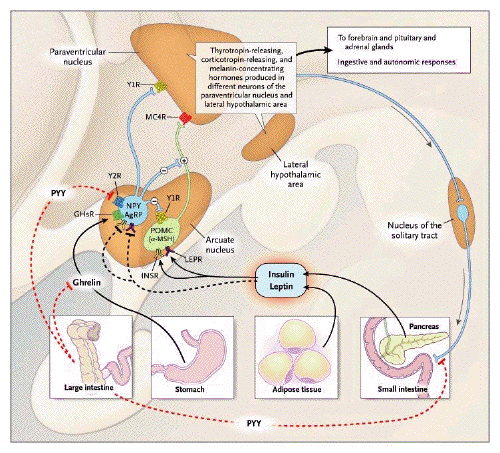
- La ghréline est un ligand
endogène pour les récepteurs
à l'hormone de croissance (GH) et
apparaît comme un peptide inducteur de la
faim et de la recherche de nourriture. La
ghréline, les hypocrétines (ou
orexines) et le neuropeptide Y (NPY) forment un
circuit hypothalamique de régulation de
la satiété. Hypocrétines et
NPY sont également impliqués dans
la régulation de l'éveil. La
ghréline inhibe le sommeil tant profond
que paradoxal en fonction de la
luminosité. Il est facile de concevoir
que la recherche de nourriture nécessite
un éveil adapté.
L'expérimentation chez le rat indique que
l'injection de gréhline stimule
l'éveil, le "grooming" (auto et
hétéro-nettoyage) et semble
induire des bâillements, en période
nocturne, c'est à dire d'activité
pour le rat, alors que la ghréline
injectée au lever du jour induit le
sommeil. La ghréline est donc un peptide
candidat dans l'induction des bâillements
associés à la
satiété, rythmée par le
cycle éveil-sommeil (Szentirmai,
2006).
- Chez l'animal, il est démontré
que la faim réduit la durée de
sommeil, modifie le rythme circadien des
activités motrices afin d'augmenter le
temps consacré à la recherche de
nourriture. Ceci résulte de l'adaptation
de l'activité des neurones
hypocrétinergiques de l'hypothalamus
latéral en fonction des taux plasmatiques
périphériques du glucose, de la
ghréline (orexigène) et de la
leptine (Sakurai,
2006). La leptine a permis de hisser le tissu
adipeux au rang d'organe endocrine. Ce peptide a
une fonction anorexigène lors de la
saturation lipidique des adipocytes,
défaillante chez l'obèse, par
possible défaut de transduction au
travers de la barrière
hémato-encéphalique (Banks,
2006). Il existe donc des liens très
étroits entre éveil et
satiété, expliquant aussi
l'existence de bâillements
associés. Actuellement aucun travail n'a
été conduit sur un lien entre
leptine et bâillements.
-
- Les stéroïdes sexuels modulent
l'activité de l'ocytocine et de la
dopamine au niveau du PVN. Chez le rat ou le
singe macaque, les bâillements
disparaissent après castration et sont
restaurés par des injections de
testotérone exogène. Les
bâillements sont décrits, en
éthologie, comme plus fréquents
ches les mâles alpha des groupes de
macaques. Les oestrogènes inhibent les
bâillements induits par l'apomorphine
alors que la progestérone favorise
d'abord des bâillements puis le sommeil.
On peut ainsi envisager que les
bâillements répétés
bien connus par les femmes enceintes au premier
trimestre de leur grossesse, et toutes les
occurences de bâillements liés
à la sexualité résultent de
l'interaction des stéroïdes sexuels
au niveau du PVN. (Deputte,
1994; Holmgren
1980; Seuntjens,
2004).
-
- Développement du bâillement
au cours de l'ontogenèse.
-
- Les gènes homéotiques (Hox),
gènes architectes, délivrent une
information positionnelle. Ils
représentent quatre groupes de
gênes codant pour la transcription de
facteurs (les protéines Hox)
impliqués dans l'orchestration de la mise
en place de l'axe rostro-caudal de l'organisme,
incluant la segmentation du tronc
cérébral et du diencéphale
d'une part, la formation des membres
supérieurs d'autres part. Ils commandent
l'individualisation du massif facial et du
cerveau à partir d'une structure
embryonnaire commune, l'ectoblaste. Le
pôle céphalique comporte une
segmentation encéphalo-faciale et
encéphalo-cervicale avec une
correspondance topographique stricte: les
structures naso-frontales et
prémaxillaires sont liées aux
hémipshères; les structures
maxillo-mandibulaires et cervicales
antérieures sont unies au tronc
cérébral et à ses nerfs
(Borday,
2004).
-
- Au début du troisième mois,
l'embryon devient un foetus grâce à
l'apparition des premières
séquences motrices orales et
pharyngées sous la dépendance de
la myélinisation du tronc
cérébral. Les mouvements des joues
et de la langue participent à la
formation du palais par l'initiation de
mouvements de traction
antéro-postérieurs alors que les
valves palatales primordiales sont
orientées verticalement.
L'activité motrice de la langue et de la
bouche est constamment accompagnée de
mouvements du cou comme l'illustrent les
échographies qui, dès 12 à
15 semaines de grossesse, visualisent succions,
déglutitions, bâillements et
pandiculations. L'activité
oro-pharyngée se coordonne ainsi avec les
régulations respiratoire, cardiaque et
digestive de même localisation
neuro-anatomique. L'extension du processus de
myélinisation au néocortex
temporal et frontal se complète
jusqu'à 22 à 24 semaines. Ce
décalage chronologique illustre la Loi de
Haeckel
"l'ontogenèse récapitule la
phylogénie". Le tronc
cérébral ou cerveau reptilien
devient fonctionnel avant le cortex.
- Succions, déglutitions,
bâillements et pandiculations ont donc une
importance dans le développement
fonctionnel du système nerveux alors que
la puissante contraction musculaire qu'ils
représentent a un coût
métabolique élevé. Une
hypothèse structurale suppose un
accroissement d'activation et de recrutement des
neurotrophines qui génèrent toute
une cascade de nouvelles synapses, de nouveaux
circuits neuronaux au niveau
diencéphalique et du tronc
cérébral. Ce mécanisme de
développement,
activité-dépendant, a clairement
été identifié comme un des
processus affectant la maturation fonctionnelle
précoce des systèmes sensoriels et
moteurs. Ce phénomène
d'activité-dépendance est un
processus ubiquitaire de maturation
cérébrale par lequel le
développement d'une région, d'une
structure participe au développement
d'autres régions, d'autres structures
(Marder, 2005).
-
- La phylogenèse suggère que le
repos nocturne des poïkilothermes a
probablement évolué vers le
sommeil paradoxal (REM sleep) qui est
caractérisé par une hypotonie
musculaire périphérique
commandée par des noyaux situés
à la partie dorsale du tronc
cérébral, situé
rostralement par rapport au pont (Nicolau,
2000). L'étude du sommeil tant du foetus
humain qu'animal, indique que la première
forme de sommeil a des caractéristiques
de sommeil actif ou agité qui
représente une forme immature de sommeil
paradoxal et est encore très
prépondérant à la
naissance. Siegel
(2005) a montré que plus le cerveau est
immature à la naissance, plus il existe
de sommeil paradoxal. Les mécanismes
commandant le sommeil paradoxal sont les
premiers fonctionnels et les seuls actifs
initialement en raison de la seule
myélinisation du tronc
cérébral et du diencéphale.
Ensuite le sommeil lent apparaît quand les
structures thalamo-corticales deviennent
matures. Il apparaît donc que le
contrôle de l'activité neuronale
exercée par le sommeil paradoxal
participe du mécanisme, activité
dépendant, de maturation fonctionnelle du
cortex. Il peut être inféré
qu'au tout début de la vie foetale, le
sommeil paradoxal (et le bâillement?)
dirige l'évolution de la maturation
corticale par sa stimulation neuronale. De la
vie prénatale à la vie postnatale,
un pattern comportemental montre un
développement parallèle de
l'apparition du sommeil paradoxal et du
bâillement. C'est ainsi que la
durée du sommeil paradoxal décline
de 50% du temps de sommeil, chez le
nouveau-né à une à deux
heures chez l'adulte, que le nombre de
bâillements passe de 30 à 50 par
jour chez le nouveau né à moins de
20 par jour chez l'adulte. Cette diminution
intervient essentiellement de la naissance
à la fin de la puberté (Walusinski,
2006).
-
- Bâillements et pandiculations sont
donc des comportements moteurs à commande
centrale, le cerveau reptilien de P. McLean,
remarquablement conservée au cours de
l'Evolution, apparaissant de façon
contemporaine au sommeil paradoxal avec lesquel
ils partagent la même origine
phylogénique.
-
- Autres conséquences des
bâillements et pandiculations
-
- Nous allons passer en revue les autres
effets centraux et périphériques
induits par la puissante contraction musculaire
des bâillements et pandiculations.
-
- Domenico
Cotugno est le premier, en 1764, a
évoqué la circulation du liquide
céphalorachidien (LCR) (Pearce
2004). Les battements cardiaques et les
mouvements respiratoires transmettent des
variations de pressions dans les ventricules
cérébraux. Chaque inspiration
profonde est suivie d'une augmentation du
débit du LCR au niveau du IV°
ventricule (Schroth
1992; Bouyssou
1985). L'étude de la cinématique
mandibulaire montre que celle-ci s'associe
à l'inspiration pour modifier la
circulation intra-crânienne. Lepp
(1982) décrit "les mouvements
mandibulaires qui ont le rôle de mettre en
action selon les besoins la pompe
musculo-veineuse ptérygoïdienne qui
fonctionne en haut de l'espace parapharyngien
antérieur ou préstylien. De cette
manière, la pompe paratubaire peut
s'intercaler dans le mécanisme
d'écoulement du sang veineux hors de
l'endocrâne et principalement via le sinus
canalis ovalis. Ainsi, la citerne
ptérygoïdienne, correspondant
à la pars caverna du plexus
ptérygoïdien et elle-même
prolongement extra-crânien et
transovalaire du sinus caverneux, joue un
rôle important comme station
intermédaire d'accélération
pour l'écoulement en retour du sang
cérébral (...). On pourrait avec
raison considérer la cinématique
mandibulaire conjointement avec le muscle
ptérygoïdien latéral comme un
veino-moteur, d'autant plus que les deux
ensembles représentent en fait le
démarreur proprement dit pour la mise en
marche de l'action de pompage musculo-veineux
alterné de la pars cavernosa du plexus
ptérygoïdien. Elle est
évidemment particulièrement
efficace lors de l'acte de bâillement
isolé ou proprement dit,
c'est-à-dire surtout lorsque la bouche
atteint son ouverture maxima. Cependant,
répétons-le, le bâillement
lui-même n'est souvent que l'initiation
d'une réaction motrice musculo-veineuse
en chaîne, étendue aux membres et
à toute la musculature squelettique sous
forme d'ondes toniques propagées en
direction rostro-caudale jusqu'au bout des
doigts et des orteils."
-
- Il apparaît ainsi que l'ample
inspiration et l'ouverture de bouche maximale
accélère la circulation du LCR.
Déjà en 1912, Legendre
et Piéron ont mis en évidence
la présence d'un facteur hypnogène
dans le LCR et s'y accumulant pendant la veille.
Cette recherche de facteurs, humoraux et non
neuronaux, inducteurs du sommeil, vieille de
près de 100 ans, a fait passer en revue
plus de 50 molécules. Actuellement, une
prostaglandine PGD2 agit comme une hormone
d'activité locale, produite par les
méninges. Sa fixation sur un
récepteur spécifique est suivie
d'une transduction depuis la leptoméninge
vers la parenchyme cérébral en
activant la fabrication d'adénosine,
celle-ci ayant un effet inducteur du sommeil au
niveau du noyau VLPO de l'hypothalamus
antérieur. Il se peut donc que
bâillements et pandiculations, en
induisant une accélération de la
clairance de PGD2, réduisent la
propension à l'endormissement (Hayaishi
2005).
-
- Bâillements et pandiculations
provoquent, à l'acmé de l'ample
inspiration, une augmentation de la pression
intra-thoracique, suivie d'une dépression
rapide, lors de l'expiration qui la suit. Il en
résulte un blocage du retour veineux et
lymphatique suivi d'un flux
accéléré. B. Nolman
(2006) propose un rôle d'activation de la
circulation lymphatique drainant le canal
thoracique vers la veine cave et pouvant ainsi
faire jouer aux bâillements un rôle
"immunitaire". De façon comparable,
l'ample inspiration du bâillement ouvre
les alvéoles en atélectasie et
participe à l'étalement du
surfactant, comme le fait un soupir. Cela
pourrait concourir à améliorer la
fonction ventilatoire. Le bâillement
dirigé est ainsi utilisé dans les
suites opératoires en chirurgie
thoracique, notamment (Cahill,
1978).
-
- A l'acmé d'un bâillement,
l'ouverture de la trompe d'Eustache aère
la caisse du tympan. Associée à
l'occlusion palpébrale, la baisse de
l'audition ainsi provoquée, concourt
à une brève déconnexion
sensorielle de l'environnement du
bâilleur. Lors de pathologies
rhino-pharyngées ou de variations
altudinales (montagne, vols aériens), le
bâillement constitue un moyen
thérapeutique de
reperméabilisation tubaire assurant
l'amélioration des surdités de
transmission, inflammatoires ou fonctionnelles
(Laskiewicz,
1953; Winther,
2005). Par l'extrême ouverture
pharyngo-laryngée, qui caractérise
les bâillements au niveau des voies
aériennes supérieures, les
bâillements participent à une forme
de relaxation de la musculature
pharyngolaryngée, permettant une reprise
de la parole. Cette musculature
extrinsèque et intrinsèque de
larynx est particulièrement sensible au
stress émotionnel. Son hypercontraction
est le dénominateur commun de toutes les
formes de dysphonies et aphonies fonctionnelles
ou psychogènes. Le bâillement est
une thérapeutique des surmenages vocaux.
Elle est efficace pour combattre
l'élévation excessive du larynx et
la constriction de la glotte qui les
caractérisent. Ces surmenages
correspondent à un effort
tonico-spastique des muscles du larynx qui
provoque son ascension. Le bâillement
ouvre la glotte à son maxima et
repositionne le larynx au plus bas de sa course,
réduisant l'effort musculaire. Les
professeurs de chant enseignent à leurs
élèves des techniques de
bâillements provoqués, forme de
relaxation laryngée. C'est ainsi qu'il
n'est pas rare de voir des chanteurs
d'opéra bâiller avant d'entrer en
scène (Xu,
1991; Boone,
1993).
-
- Bâillements et pandiculations
acteurs de l'intéroception et du
schéma corporel?
-
- L'école apprend aux enfants, suivant
la tradition aristotélicienne, que nous
disposons de cinq sens. Mais il peut être
proposé que nous
bénéficions des informations d'un
sixième sens, l'intéroception, la
capacité de percevoir des stimuli
sensoriels internes à notre corps. Le
terme intéroception, ou
somesthésie végétative, a
été proposé par Sherrington
en 1905. En 1749, Buffon
proposait la volupté comme sixième
sens reprenant l'idée de Cardan
en 1554. La volupté n'est-elle pas le
résultat d'une intéroception
harmonieuse ? Le monde animal connaît
d'autres sens qui nous sont inconnus:
l'électroréception, la
magnétoréception, et
l'écholocalisation par ultrasons. Nous
nous proposons de montrer comment le
bâillement appartient à
l'intéroception et ainsi participe
à notre éveil et à notre
schéma corporel.
-
- L'éveil est essentiel à la
conscience. Celle-ci nécessite la
capacité d'intégrer des
informations sensorielles informant du monde
environnant, des sensations du ressenti de notre
état physique interne, modulées
par les émotions et la mémoire.
Les sensations afférentes en provenance
du système musculo-squelettique
convergent par les voies spinothalamiques et
spinoréticulaires vers le thalamus, les
noyaux du raphé et de là vers le
cortex sensitif pariétal ascendant. Le
thalamus et le PVN participent d'un circuit
envoyant et recevant des influx du locus
coeruleus, des noyaux tubéro-mamillaires,
toutes structures responsables des
réflexes autonomiques. Les nerfs
crâniens trijumeaux (V), faciaux (VII),
pneumogastriques (X) et les racines cervicales
C1-C4, moteurs et/ou sensitifs convoient aussi
des somesthésies qui convergent vers le
noyau du tractus solitaire (NTS), interface des
informations périphériques,
nécessaire à la stimulation de la
réticulée ascendante du tronc
cérébral, du locus coeruleus en
particulier, source de l'activation des
systèmes d'éveil
(adrénergique au pont, dopaminergique aux
pédoncules, histaminergique à
l'hypothalamus, cholinergique au noyau
basifrontal de Meynert). Le NTS est
impliqué dans les trois comportements
l'éveil, la satiété et la
sexualité. Les neurones du NTS projettent
aussi sur le noyau parabrachial qui,
lui-même, projettent vers de multiples
sites du tronc cérébral, du
diencéphale, du thalamus.
-
- Mais surtout, ces structures projettent vers
le secteur des sensations viscérales de
l'insula, de l'amygdale et du cortex
latéro frontal, surtout droit (Steriade,
2001; Stehberg,
2001, McHaffie,
2005). C'est par ces circuits qu'une
activité homéostasique automatique
sous-corticale inconsciente parvient à
engendrer une représentation consciente.
L'intégration autonomique, somatique et
limbique permet ainsi d'extraire une perception
corporelle d'où peut émerger une
sensation de plaisir. Il est donc proposé
que les variations d'état du tonus
musculaire périphérique
antigravifique, transmises par ces voies,
déclenchent bâillements et
pandiculations qui, par les puissantes
contractions musculaires, activent les
systèmes d'éveil. Le ressenti de
l'activité musculo-squelettique provoque
une sensation de bien-être, d'acutisation
de la thymie nécessaire à la
représentation du schéma corporel,
lors de l'éveil par exemple, comme le
proposent les
théories de James-Lange des
émotions ou A. Damasio
avec sa theorie de "somatic
marker hypothesis of consciousness."
-

- Echokinésie du Bâillement,
théorie de l'esprit ("Theory of mind") et
empathie.
-
- Les humains sont des êtres sociaux.
Une des fonctions primordiales de
l'encéphale est de nous donner la
capacité d'interagir de façon
optimale avec les autres. Le succès des
interactions sociales réside dans la
capacité à comprendre les autres
au niveau des actions motrices
(intentionnalité), des perceptions
émotionnelles, d'une intégration
cognitive mnésique et comparative
séparant le soi de l'autre (empathie,
altruisme), toutes capacités que le
psychologie anglo-saxonne a unifié sous
le concept de "The
theory of mind" (TOM). Il est connu, depuis
toujours, que le bâillement est
"contagieux"; l'éthologie parle de
réplication comportementale et, la
neurologie, depuis JM. Charcot,
d'échokinésie.
En quoi cette échokinésie
confère aux bâillements une forme
de communication sociale non verbale participant
de la TOM et de l'empathie ?
-
- La découverte des neurones miroirs
par Rizzolatti
et Gallese
(1996) ouvre à une explication
neurophysiologique de la TOM. La promotion des
compétences exploratrices de
l'environnement, les processus de prises de
décisions, notamment en cas d'urgence
face à un prédateur, la
préparation de l'action en
générale, répondent chez la
plupart des vertébrés à
l'activation de neurones miroirs dans les aires
corticales motrices. Ils s'activent lors de la
perception des mouvements et d'action de
conspécifiques indiquant que la
génération de l'action
intentionnelle et l'imagerie mentale de celle-ci
partagent les mêmes structures neuronales.
Ainsi, sur un trottoir parisien, l'approche du
piéton décelé par un pigeon
déclenche automatiquement l'envol de la
troupe dont la majorité n'a pas eu
perception du danger. Résultat de
réponses adaptatives
sélectionnées par
l'évolution, cet automatisme moteur
coopératif valorise la vie en groupe en
terme de sécurité face au
prédateurs. L'échokinésie
du bâillement ne répond pas
à ce mécanisme comme l'indique son
délai d'apparition et son inconstance. En
effet, n'est sensible à
l'échokinésie qu'un individu dans
un état mental peu stimulé
(transport en commun), alors qu'un travail
intellectuel soutenu le rend insensible.
-
- Schürmann
et al.(2005) ont confirmé, par
exploration en IRM fonctionnelle, l'absence
d'activation des neurones miroirs de l'aire de
Broca
chez l'Homme (cortex frontal
postéro-inférieur de
l'hémisphère gauche), lors de
l'échokinésie du bâillement,
contrairement à l'observation gestuelle
pendant laquelle, ceux-ci s'activent tant dans
l'exécution que dans l'observation d'une
activité motrice (décodage de
l'intentionnalité). Ces
éléments éthologiques et
neurophysiologiques montrent que
l'échokinésie du bâillement
n'est pas une imitation motrice.
-
- La reconnaissance visuelle de
l'environnement met en jeu différents
circuits neuronaux distinguant les objets
inanimés des êtres vivants
(Puce,
2003). La reconnaissance des visages humains
répond à l'activation de neurones,
spécifiquement dédiés, au
niveau temporal. La région temporal
inférieur (IT) (Afraz,
2006; Leopold,
2006) permet une identification immédiate
d'un visage dans sa globalité, tant pour
l'identité que pour l'expression, en
possédant, apparemment, une
mémorisation autonome, non hippocampique.
Le sulcus
temporal supérieur (STS) s'active,
lui, spécifiquement lors de perception
des mouvements des yeux, de la bouche,
suggérant son implication dans la
perception visuelle des émotions.
Schürmann
et al. (2005) ont montré l'activation du
STS lors de l'échokinésie du
bâillement, de façon automatique et
involontaire, se transmettant vers l'amygdale
gauche, le cortex cingulaire postérieur
et le précuneus. Ces structures sont
associées à la discrimination des
émotions exprimées par la face
humaine et, notamment, dans
l'appréciation de la
véracité du ressenti
exprimé.
-
- Platek et
al. (2003;
2005)
ont, en IRMf, trouvé une
corrélation entre activation des circuits
neuronaux au-delà du STS et traits de
personnalités. Les sujets
qualifiés d'empathiques, très
sensibles à l'échokinésie
du bâillement activent amygdale et cortex
cingulaire, alors que les sujets
qualifiés de schizoïdes, insensibles
à la réplication du
bâillement, n'activent pas ces structures.
L'étude de la neurophysiologie de
l'empathie (Carr,
2003) retrouve une similarité des zones
activées (STS, insula, amygade, cortex
cingulaire) à l'exception de l'absence
d'activité des lobes frontaux lors de
l'échokinésie du bâillement.
Ainsi, il semble qu'alors que la
compréhension de l'intentionnalité
(neurones miroirs moteurs), le partage des
émotions (neurones miroirs de l'insula,
amygdale et cortex pariétal droit)
nécessitent, pour être
décodés, une activation neuronale
commune, action - perception,
simultanément à une inhibition
frontale (activation orbito-frontale)
inhibitrice de l'extériorisation motrice,
l'échokinésie du bâillement
n'a pas la capacité d'être
inhibée involontairement par absence de
relais frontaux. Par contre l'activation
temporo-pariétale droite autorise la
différenciation entre soi et l'autre,
identifiant, au niveau conscient, le rôle
déclencheur du bâillement de
l'autre (Decety,
2006).
-
- Alors que le bâillement apparaît
universel chez les vertébrés, il
semble que seuls les primates soient capables
d'une échokinésie. Anderson
(2004) a montré que des chimpanzés
visionnant une vidéo de bâillements
de conspécifiques, bâillaient
à la suite, de façon similaire aux
humains dans une situation analogue. Bien que
l'existence d'une TOM chez le chimpanzé
soit toujours l'objet de controverses (Povinelli,
2003), l'existence d'une
échokinésie des bâillements
plaide en faveur d'une théorie de
différents niveaux de TOM,
peut-être secondairement à des
voies différentes de l'évolution
des capacités cognitives des
hominidés. La pathologie psychiatrique
humaine dissèque, elle aussi, de
façon comparable, la TOM (Blair,
2005).
-
- Anderson
(2003) a montré que l'enfant
n'était sensible à
l'échokinésie du bâillement
qu'au cours de la sixième année de
vie, c'est à dire après avoir
acquis la capacité de
réfléchir à ce que l'autre
pense, à attribuer des états
mentaux à autrui (Gergely,
2003). Un état de maturation cognitive
d'ordre fonctionnel est donc nécessaire
afin d'être sensible à
l'échokinésie du
bâillement.
-
- En résumé, un lien
phénoménologique apparaît
entre la capacité à attribuer un
état mental à autrui (TOM), base
de l'empathie et l'échokinésie du
bâillement. A côté de la
hiérarchie neuro-anatomique
séparant la TOM en niveaux
sensorimoteurs, émotionnels et cognitifs
((Singer, 2006), l'échokinésie du
bâillement autorise une dissociation de la
TOM, par son ontogenèse et sa
phylogenèse, en différents niveaux
développementaux, sous-tendus par une
activation différenciée de
circuits neuronaux spécifiques.
L'échokinésie du bâillement
aurait conféré un avantage
sélectif, en permettant une
synchronisation efficace des niveaux de
vigilance entre les membres d'un groupe social.
Elle participerait d'une forme d'empathie
instinctive involontaire, qualifiable de
rudimentaire, probablement apparue tardivement
au cours de l'évolution des
hominidés.
-
- Remerciements à BL
Deputte pour ces commentaires et
corrections.
-
- Bibliographie
-
- Abrahams
VC, Richmond FJ. Specialization of
sensorimotor organization in the neck muscle
system. Prog Brain Res. 1988;76:125-35.
-
- Abrahams
VC, Kori AA, Loeb GE, Richmond FJ, Rose PK,
Keirstead SA. Facial input to neck
motoneurons: trigemino-cervical reflexes in the
conscious and anaesthetised cat. Exp Brain Res.
1993;97(1):23-30.
-
- Afraz
SR, Kiani R, Esteky H. Microstimulation of
inferotemporal cortex influences face
categorization. Nature.
2006;442(7103):692-695.
-
- Anderson
JR, Meno P. Psychological influences on
yawning in children. Current Psychology Letters
Behaviour, Brain, & Cognition.
2003;2(11).
-
- Anderson
JR, Myowa-Yamakoshi M, Matsuzawa T.
Contagious yawning in chimpanzees. Proc Biol
Sci. 2004;271 Suppl 6:S468-470.
-
- André-Thomas,
de Ajuriaguerra J. Etude sémiologique
du tonus musculaire. Flammarion éd. Paris
1949. 844p.
-
- Banks
WA. The blood-brain barrier as a regulatory
interface in the gut-brain axes. Physiol Behav.
2006, in press.
-
- Barbizet
J. Le bâillement. Concours Med.
1958;80(5):537-538.
-
- Bejan
A, Marden JH. Unifying constructal theory
for scale effects in running, swimming and
flying. J Exp Biol. 2006;209:238-248.
-
- Blair
RJ. Responding to the emotions of others:
dissociating forms of empathy through the study
of typical and psychiatric populations.
Conscious Cogn. 2005;14(4):698-718.
-
- Boone DR,
McFarlane SC. A critical view of the
yawn-sigh as a voice therapy technique. J Voice.
1993;7(1):7580.
-
- Borday
C, Wrobel L, Fortin G, Champagnat J,
Thaeron-Antono C, Thoby-Brisson M.
Developmental gene control of brainstem
function: views from the embryo. Prog Biophys
Mol Biol. 2004;84(2-3):89-106.
-
- Bouret
S, Sara SJ. Network reset: a simplified
overarching theory of locus coeruleus
noradrenaline function. Trends Neurosci.
2005;28(11):574-582.
-
- Bouyssou M,
Tricoire J. Experimental detection of a
cervical arousal mechanism of yawning, enhancing
intracerebral (CSF) fluid pressure. J Dental
Res. 1985;64:721.
-
- Buffon
GL. De l'homme, histoire naturelle. Paris
Imprimerie Royale. 1749; 3:370.
-
- Cahill CA.
Yawn maneuver to prevent atelectasis. AORN J.
1978;27(5):1000-1004.
-
- Campbell
SS. Spontaneous termination of ad libitum
sleep episodes with special reference to REM
sleep. Electroencephalogr Clin Neurophysiol.
1985;60(3):237242.
-
- Cardan
J. De subtilitate. Milano. Basileae.
1154;XIII:384.
-
- Carr
L, Iacoboni M, Dubeau MC, Mazziotta JC, Lenzi
G. Neural mechanisms of empathy in humans: a
relay from neural systems for imitation to
limbic areas. Proc Natl Acad Sci USA.
2003;100(9):5497-5502.
-
- Claparède
Ed. Pourquoi bâille-t-on ?
L'éducateur. 1924;60(25):65-70.
-
- Cotugno
Domenico. De ischiade nervosa commentarius.
Neapoli, apud Fratres Simonios, 1764.
-
- Damasio
AR. Somatic markers and the guidance of
behavior: theory and preliminary testing. In
Frontal lobe function and dysfunction. Levin HS
et al. Ed. Oxford University Press. 1991.
217-229.
-
- Darwin
E. Zoonomia, or the laws of organic life. Of
the sense of the extension. London. Johnson.
1804;1(sectXIV):7.
- en
ligne
-
- Decety
J, Grezes J. The power of simulation:
imagining one's own and other's behavior. Brain
Res. 2006;1079(1):4-14.
-
- Deputte BL,
Johnson J, Hempel M, Scheffler. Behavioral
effects of an antiandrogen in adult male rhesus
macaques (Macaca mulatta). Horm Behav.
1994;28(2):155-164.
-
- Dumpert
V. Zur Kenntnis des Wesens und der
physiologischen Bedeutung des Gähnens. Z
für Psychologie und Neurologie.
1921;27(1-2):82-95.
-
- Forte MC.
Le bâillement. Thèse Doctorat en
médecine, n°117. Bordeaux. 1982.
89p
-
- Gergely
G. The development of teleological versus
mentalizing observational learning strategies in
infancy. Bull Menninger Clin.
2003;67(2):113-131.
-
- Hayaishi
O. Molecular mechanisms of sleep-wake
regulation: a role of prostaglandin D2 and
adenosine. In Sleep, circuits and functions.
Luppi PH ed. CRC press. Boca Raton.
2005:65-79.
-
- Holmgren
B, Urba-Holmgren R, Aguiar M, Rodriguez R.
Sex hormone influences on yawning behavior. Acta
Neurobiol Exp (Wars).1980;40(2):515-519.
-
- Humphrey
T. The development of mouth opening and
related reflexes involving the oral area of
human fetuses. Ala J Med Sci.
1968;5(2):126-157.
-
- James
W (1842-1910). What is an emotion? Mind.
1884;9:188-205.
 William
James 1842 -1910 William
James 1842 -1910-
- Lange
KG (1834-1900). Om Sindsbevægelser et
psyko-fysiologisk Studie. Lund Ed.
Kjøbenhavn. Denmark. 1885, 91p.
-
- Laskiewicz
A. The role of the Eustachius tube and the
tympanal muscles in yawning. Rev Laryngol Otol
Rhinol. 1953;74(5-6):309-316.
-
- Legendre
R, Piéron H. De la
propriété hypnotoxique des humeurs
développée au cours d'une veille
prolongée C.R. Société de
Biologie de Paris. 1912;70: 210-212.
-
- Leopold
DA, Bondar IV, Giese MA. Norm-based face
encoding by single neurons in the monkey
inferotemporal cortex. Nature.
2006;442(7102):572-575.
-
- Lepp FH.
Recherches sur la partie caverneuse du plexus
veineux ptérygoïdien et ses rapports
avec le système des espaces ou fentes de
glissement parapharyngiens. Remarques sur la
signification physiologique du bâillement.
Bull. Group. Int. Rech. Sci. stomato; et Odonto.
1982;25:251-290.
-
- Marder E, Rehm KJ. Development of central
pattern generating circuits. Curr Opin
Neurobiol. 2005;15(1):8693.
-
- McHaffie
JG, Stanford TR, Stein BE, Coizet V, Redgrave
P. Subcortical loops through the basal
ganglia. Trends Neurosci.
2005;28(8):401-407.
-
- McLean P.
Evolutionary psychiatry and the triune brain.
Psychol Med. 1985;15:219-221.
-
- Nicolau
MC, Akaarir M, Gamundi A, Gonzalez J, Rial
RV. Why we sleep: the evolutionary pathway
to the mammalian sleep. Prog Neurobiol.
2000;62(4):379-406.
-
- Nolman B.
The Lymphatic pump. Yawnology. 2006.
-
- Pearce
JMS. Cotugno and cerebrospinal fluid. J
Neurol Neurosurg Psych. 2004;75:1299.
-
- Platek
SM, Critton SR, Myers TE, Gallup GG.
Contagious yawning: the role of self-awareness
and mental state attribution. Brain Res Cogn
Brain Res. 2003;17(2):223-227.
-
- Platek
SM, Mohamed FB, Gallup GG Jr. Contagious
yawning and the brain. Brain Res Cogn Brain Res.
2005;23(2-3):448-452.
-
- Povinelli
DJ, Vonk J. Chimpanzee minds: suspiciously
human? Trends Cogn Sci. 2003;7(4):157-160.
-
- Puce
A, Perrett D. Electrophysiology and brain
imaging of biological motion. Philos Trans R Soc
Lond B Biol Sci. 2003;358(1431):435-445.
-
- Rizzolatti
G, Fadiga L, Gallese
V, Fogassi L. Premotor cortex and the
recognition of motor actions. Brain Res Cogn
Brain Res. 1996;3(2):131-141.
-
- Rizzolatti
G, Fadiga L, Fogassi L, Gallese
V. Resonance behaviors and mirror neurons. Arch
Ital Biol. 1999;137(23):85-100.
-
- Sakurai
T. Roles of orexins and orexin receptors in
central regulation of feeding behavior and
energy homeostasis. CNS Neurol Disord Drug
Targets. 2006;5(3):313325.
-
- Sato-Suzuki I,
Kita I, Oguri M, Arita H. Stereotyped
yawning responses induced by electrical and
chemical stimulation of paraventricular nucleus
of the rat. J Neurophysiol.
1998;80(5):2765-2775.
-
- Schroth
G., Klose U. Cerebral flow, physiology of
respiration-related pulsations. Neuroradiology.
1992;35:1015.
-
- Schürmann
M, Hesse MD, Stephan KE, Saarela M, Zilles K,
Hari R, Fink GR. Yearning to yawn: the
neural basis of contagious yawning. Neuroimage.
2005;24(4):1260-1264.
-
- Seuntjens W.
On yawning or the hidden sexuality of the human
yawn. Thesis. Vrije Universiteit. 464p.
Amsterdam. Oct 2004.
-
- Siegel
JM. Sleep phylogeny : clues to the evolution
and function of sleep. In Luppi PH ed. Sleep :
circuits and functions. CRC Press. Boca Raton.
2005. 163-176.
-
- Singer T. The neuronal basis and ontogeny of
empathy and mind reading: Review of literature
and implications for future research. Neurosci
Biobehav Rev. 2006; in press.
-
- Stehberg
J, Acuna-Goycolea C, Ceric F, Torrealba F.
The visceral sector of the thalamic reticular
nucleus in the rat. Neurosci.
2001;106(4):745-755.
-
- Steriade
M. Impact of network activities on neuronal
properties in corticothalamic systems. J
Neurophysiol. 2001;86(1):1-39.
-
- Szentirmai
E, Hajdu I, Obal F Jr, Krueger JM.
Ghrelin-induced sleep responses in ad libitum
fed and food-restricted rats. Brain Res.
2006;1088(1):131-140.
-
- Walusinski O,
Deputte BL. Le bâillement:
phylogenèse, éthologie,
nosogénie. Rev Neurol (Paris).
2004;160(11):1011-1021.
-
- Walusinski
O, Kurjak A, Andonotopo W, Azumendi G. Fetal
yawning assessed by 3D and 4D sonography. The
Ultrasound Rev Obs Gyncecol.
2005;5(3):210-217.
-
- Walusinski O.
Yawning: Unsuspected avenue for a better
understanding of arousal and interoception. Med
Hypotheses. 2006;67(1):6-14.
-
- Winther
B, Gwaltney JM Jr, Phillips CD, Hendley JO.
Radiopaque contrast dye in nasopharynx reaches
the middle ear during swallowing and/or yawning.
Acta Otolaryngol. 2005;125(6):625-628.
-
- Xu
JH, Ikeda Y, Komiyama S. Bio-feedback and
the yawning breath pattern in voice therapy: a
clinical trial. Auris Nasus Larynx.
1991;18(1):67-77.
-
- Zafar
H, Nordh E, Eriksson PO. Temporal
coordination between mandibular and head-neck
movements during jaw opening-closing tasks in
man. Arch Oral Biol. 2000;45(8):675-682.
-
-
- Somnolter© développé par
Nomics
-
- WSL-2 Liège Science Park
- rue des Chasseurs Ardennais, 4
- B-4031 Angleur (Belgium)
-
Voir
défintions par Emile
Littré
|




 William
James 1842 -1910
William
James 1842 -1910